医疗器械唯一器械标识(Unique Device Identification,UDI)是通过全球公认的器械标识和编码标准创建的一系列数字、字母或字符,它包括产品标识和生产标识,用于对医疗器械进行唯一性识别,UDI被视作医疗器械产品在供应链中的唯一的“身份证”。
UDI全称-医疗器械唯一标识(Unique Device Identification,),是医疗器械产品的电子身份证。
UDI由DI和PI构成:
DI(Device Identifier)产品标识
PI(Production Identifier) 生产识别
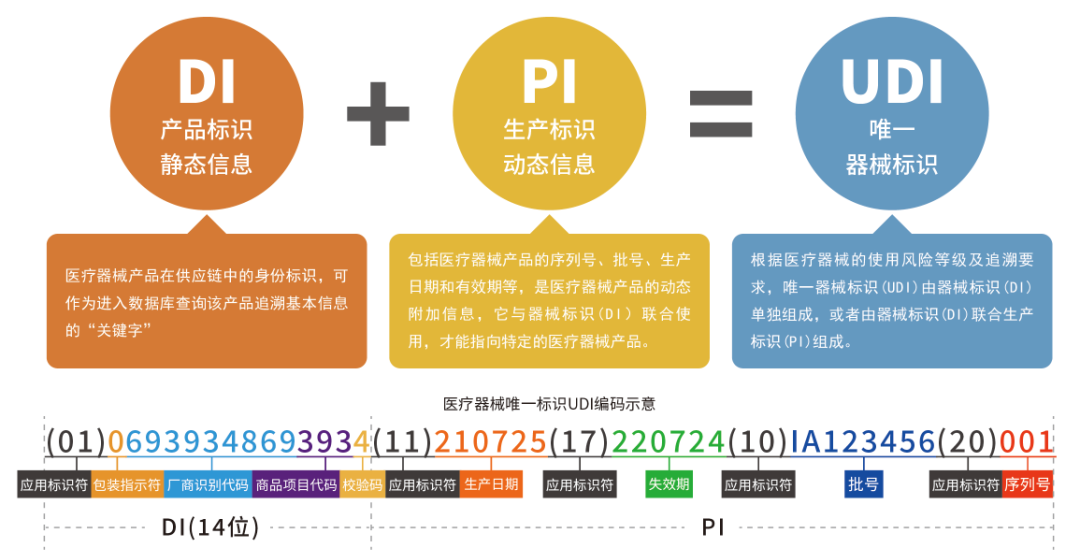
其中产品标识(DI)为识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是产品的静态信息;生产标识(PI)生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等,是产品的动态信息。
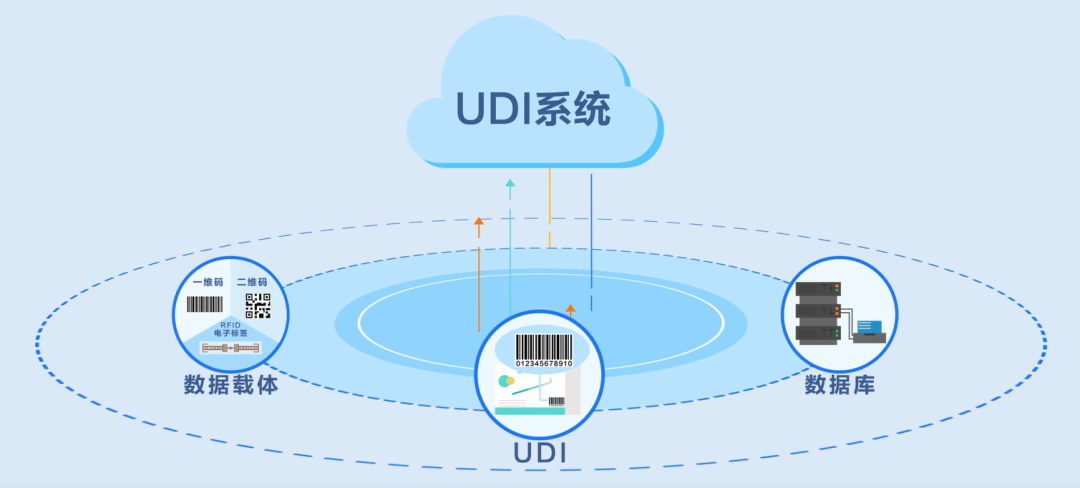
通过为每个医疗器械分配唯一的代码,实现对医疗器械的全生命周期管理,包括生产、流通、使用等环节。UDI能够提高医疗器械的管理效率,保障患者的安全,降低医疗风险。主要的应用场景如下:
1、设备追踪和管理
UDI可以帮助医疗机构准确追踪和管理医疗器械的使用情况,包括设备的位置、维护历史、保修状态等信息。这有助于提高设备利用率、减少设备滥用和损失,并确保设备按时进行维修和保养,保证其性能和安全性。
2、记录和监测
UDI可以与医疗信息系统集成,帮助医疗机构记录和监测使用的医疗器械信息。通过与患者的医疗记录相关联,医生和护士可以更好地了解使用的器械情况,有助于追踪治疗效果、推断器械对患者健康状况的影响,以及在发生器械相关问题时进行投诉和回溯。
3、安全性和风险管理
UDI使得医疗机构可以更好地识别和调查与特定医疗器械相关的安全性和风险问题。当出现质量问题、召回或报告的不良事件时,UDI可以帮助快速定位受影响的设备并进行追踪,以便及时采取纠正措施,保护患者的安全。
4、效率提升
UDI简化了数据管理和交换过程,提高了供应链管理和设备台账的效率。医疗机构可以更快速地订购和补充所需的医疗器械,减少仓库和库存成本。此外,UDI还有助于优化供应链的调度和运作,提高整体的流程效率。
我国UDI体系也正在逐步形成和完善。
2012 年《国家药品安全“十二五”规划》提出启动高风险医疗器械国家统一编码工作。
2013年,美国食品药品管理局(FDA),发布《医疗器械唯一标识系统最终规则》,制定UDI实施战略。
2017 年《“十三五”国家药品安全规划》明确提出制定医疗器械编码规则,构建医疗器械编码体系。
2019年5月,国务院,发布《深化医药卫生体制改革2019年重点工作任务》,要求“制定医疗器械唯一标识系统规则”。
2019年7月,国务院,发布《治理高值医用耗材改革方案》,明确提出“制定医疗器械唯一标识系统规则”。国家药监局会同国家卫生健康委,发布《医疗器械唯一标识系统试点工作方案》,拉开我国医疗器械唯一标识系统建设序幕。
2021年1月1日,第一批9大类69个品种开始实施医疗器械唯一标识。
2022年6月1日,其他第三类医疗器械(含体外诊断试剂)作为第二批实施品种全面实施医疗器械唯一标识。至此,第三类医疗器械已经全部要求实施UDI。
2023年2月17日起,我国第三批医疗器械开展实施工作。
2023年5月,在《医疗器械经营质量管理规范(修订草案征求意稿)》中,多项关联医疗器械唯一标识相关要求的内容被提及。
UDI系统将推动实现医疗器械智慧监管与社会共治,助力产业转型升级和健康发展,为公众提供更加安全高效的医疗服务。
图文来源于网络,如有侵权,请联系删除。

2024第31届河北(石家庄)国际医疗器械展览会第五届京津冀国际健康产业大会将于2024年3月2-4日在河北省石家庄国际会展中心(正定)举办。
2024第26届中国(青岛)国际医疗器械展暨医院采购大会将于2024年6月27-29日在青岛国际会展中心举办。
席位有限,如有意向请联系组委会

组委会在线
电话:0532-85861016
邮箱:hmmarketing@qdhaiming.com
官网:http://yl.hmed365.com
地址:青岛市山东路52号华嘉大厦4层